舶用機器CEマーキング
舶用機器CE マーキング( MED )
CEマーキングは製品が「適用の要求基準を満たしていること」を製造者あるいは販売者が責任を持って宣言するものです。主な指令として、機械、低電圧機器、圧力容器、 EMC 、無線通信電話機器、医療機器、おもちゃ、舶用機器指令などがあります。
MED (船舶機器指令、舵輪マークなどと呼ばれる)は、 CE マーキングの中で舶用材料・機器に対して発効されているEU 指令の一つです。
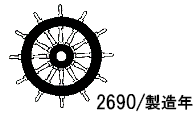
MED(舶用機器指令)の CE マーク(舵輪マーク)
CE マーキング
2016年 9 月 18 日より新 MED "2014/90/EU "が発効となりました。
これに伴う、従来の MED(96/98/EC) からの主な変更点として以下が挙げられます。
適合宣言書(Declaration of Conformity )を、Mod ule D/E/F 承認に関わった Notified Body に提出する必要があります。
適合宣言書は、対象品と一緒に本船で保持する必要があります。
Module B承認審査の際、図面、試験結果等と 併せて対象品のリスクアセスメントの結果を提出する必要があります。
EU域外の製造者は、EU 域内に代理人を選定する必要があります。
MEDの目的
EU域内の各国毎にバラバラに存在していた適用規則、規制を統合し、従来は、各国毎にまちまちであった型式認定方式を統一し、 EU 域内の流通を促進することにあります。それまで各国の型式認定が必要とされていたものがこのMED に統一されるので大幅なコストダウンが期待できます。
MEDはEU 、およびEEA諸国の船籍船に搭載する機器に取得が必要
2013年にクロアチアが加入。 2020 年 2 月現在、以下 27 ヶ国の EU 諸国、および 2 ヶ国の EEA (欧州経済領域)諸国がその対象となっています。
EU諸国
オーストリア、ベルギー、ブルガリア、クロアチア、キプロス、チェコ共和国、デンマーク、エストニア、フィンランド、フランス、ドイツ、ギリシャ、ハンガリー、アイルランド、イタリア、 ラトビア、リトアニア、ルクセンブルグ、マルタ、オランダ、ポーランド、ポルトガル、ルーマニア、スロバキア、スロベニア、スペイン、スウェーデン
EEA 諸国
アイスランド、ノルウェー
MEDの対象となる機器
以下8 つのカテゴリーに分けられ本指令内、リスト "Number (MED/1.1 MED/9/8.1) and item designation ![]() " に列記されています。
" に列記されています。
この対象品、試験基準等は MED の改正に伴い順次追加、あるいは削除されます。このリストにないものは取得対象ではありません。
- Life saving appliances
- Marine pollution prevention
- Fire protection
- Navigation equipment
- Radio communication equipment
- Equipment required under CORLEG 72
- Bulk carrier safety equipment
- Equipment under SOLAS Chapter II 1.
リスト"NUMBER(MED/1.1 MED/8.1)" の例
| 番号と名称 | 関連国際条約条項 (型式承認、搭載要求、および性能要件) | プロトタイプ テスト基準 | Module の 組み合わせ |
|---|---|---|---|
| Number and item designation | Regulations of SOLAS 74, as amended, and the relevant resolutions and circulars of the IMO, as applicable | Testing standards | Modules for conformity assessment |
| MED/1.1 Lifebuyos Row 1 of 1 | Type approval requirements - SOLAS 74 Reg. III/4, - SOLAS 74 Reg. X/3. Carriage and performance requirements - SOLAS 74 Reg. III/7, - SOLAS 74 Reg. III/34, - IMO Res.MSC.36(63)-(1994 HSC Code) 8, - IMO Res.MSC.48(66)-(LSA Code) I, - IMO Res.MSC.48(66)-(LSA Code) II, - IMO Res.MSC.97(73)-(2000 HSC Code) 8, - IMO MSC.1/Cire.1628. | - IMO Res. MSC.81(70), as amended. | B+D B+E B+F |
NOTIFIED BODY :認定機関
対象品は、Notified Body 、ノーティファイドボディー、認定機関による評価が必要です。
Notified Body は認証業務を行える製品群ごとに EU 加盟国政府の指名を受け、その政府に代わって製品の評価を行います。 BUREAU VERITAS はまた、 5. Radio communication equipment, 7. Bulk Carrier safety equipment を除く 6 つのカテゴリーにおいて、フランス政府の代理として認定業務を行っています。認定番号は 2690 。舵輪マークの横にこの番号があれば BV で認定を受けた製品です。
MODULE :モジュール
MED認証を受けるうえで、モジュールという言葉が出てきます。製造者はの右端のモジュールの組合せのうち、適切なものを選んで認証を受けることになります。たとえば B+D を選択した場合、 Module B (型式承認)で設計、性能についての評価、 Module D (製造品質保証)で製造、最終検査、出荷までの一連の製造 プロセスの評価が Notified Bodyにより行われます。
| Module B EC Type examination | リスト "Number(MED/1.1 MED/8.1)" に列記されている SOLAS 、 MARPOL などの国際条約、 ISO 、 IEC などの国際基準、規則に従い設計、製造し、 タイプテストに合格すると型式証明書( EC TYPE EXAMINATION CERTIFICATE )が発行される。 |
|---|---|
| Module D Production Quality Assurance | 製品の製造、検査、出荷までの一連の流れ、品質管理状態の審査を受 け、 QUALITY SYSTEM APPROVAL CERTIFICATE が発行される。品質 管理システムの維持審査を定期的に受け、出荷時の NB の立ち会い検 査は省略される。製造から出荷まで一貫生産の製造業者に適している。 |
| Module E Product Quality Assurance | 製品の最終検査方法、品質管理状態の審査を受け、 QUALITY SYSTEM APPROVAL CERTIFICATE が発行される。品質管理システムの維持審 査を定期的に受け、出荷時の NB の立ち会い検査は省略される。製造 は外注先、最終検査のみを自社で行う製造業者に適している。 |
| Module F Product Verification | 製品の出荷ごとに NB が最終検査に立ち会い、製品の評価を行う。 |
| Module G Unit Verification | 型式承認があてはまりにくい製品について、国際条約、国際基準、規則 に従いオーダーに合わせ設計、製造し、最終的に NB 立ち会いによる性 能試験を行い、総合的に製品の評価とする。 |
取得の一歩
取得を希望する品目がリスト"Number(MED/1.1 MED/8.1)" にあれば、すぐに取得の第一歩を踏み出しましょう。
まずは型式承認(モジュール B )の取得を考えます。リスト "Number(MED/1.1 MED/8.1)" のそれぞれの項目について製品が設計され、テスト基準に満足しているか確認します。満足していると判断できれば、 EU の認定試験所でタイプテストを実施し、テストレポートを入手します。
これに、申請書、製品の図面、スペック、取扱説明書、いずれも英文のものを BUREAU VERITAS神戸 MED担当にお送りください。
BUREAU VERITAS神戸では内容を確認のうえ、不備がなければ速やかに BV 本社に転送します。その後BUREAU VERITAS本社における承認作業を経て型式承認証書( EU Type Examination Certificate )が発行され、BUREAU VERITAS神戸で印刷のうえお客様のもとへ届けられます。
モジュールB の新規承認申請書 ![]() (66KB)(2023/12/11 更新)
(66KB)(2023/12/11 更新)
モジュールB の更新 内容修正申請書 ![]() (67KB)(2023/12/11 更新)
(67KB)(2023/12/11 更新)
第2のステップ
型式承認の審議中に製造過程のモジュール(D 、E 、F )をどうするか検討しましょう。
リスト "Number(MED/1.1 MED/8.1)" の右端の欄に X 印のついている製造過程のモジュールを選びます。
準備する書類は、申請書、 ISO9000s 証書、品質マニュアル、組織図、 QC 工程図( サンプル )です。これらは必ずしも英文である必要はありません。揃ったら、初回の工場(品質管理システム)審査の日を決めましょう。
審査当日はまず書類審査、続いてそれらの書類をもとに実際の製造検査工程を歩き、決められた通りに業務が遂行されているか確認します。事前に不備の書類は当日の提出をお願いする場合があります。その後運用についての説明ならびに質疑応答を行います。
モジュールD または E の新規申請書 ![]() (61KB)(2023/12/11 更新)
(61KB)(2023/12/11 更新)
モジュールDまたはEの更新/内容修正申請書 ![]() (59KB)(2023/12/11 更新)
(59KB)(2023/12/11 更新)
モジュールF の新規申請書 ![]() (60KB)( 2023/12/11 更新)
(60KB)( 2023/12/11 更新)
これらのモジュール、B+D 、 B+E 、 B+F のいずれかが整うと、製品に舵輪マークを貼りつけて出荷することができ ます。
舵輪マークはどこにある?
まず舵輪マークのフォントをここからダウンロード しましょう。マークは製造者で自由に作成してください。
大きさは最小 5mmです。
永久に製品に貼られる場合はちょっとお金をかけて、製品に見合った見栄えの良いマークにしましょう。マークの近くに製造工程の認証を受けた認定機関の番号、 BVであれば 2690 、製造年を併せて標示する必要があります。あまりお金をかけたくない場合は舵輪マークと2690と印刷したものを作っておき、年度は手書きで記入しましょう。こうすれば製造年が変わっても使えるのでマークがなくなるまで OK です。マークと一緒に会社のマークを刷り込むのも一案です。見栄えの良いマークは他社製品との差別化をはかり、商品の価値をさらに高めることにも なります。
舵輪マークの表示方法
すでにCEマークは貼り付けているが
すでに他のEU 指令、例えば機械指令、低電圧指令、EMC指令、RTTE指令、ATEX指令などに従って CE マーク を貼り付けていてもリスト "Number(MED/1.1 MED/8.1)" にある品目については MED 指令に従った認証が要求されます。同様の試験を行う電気電子機器についてはMEDの試験基準が EMC 指令の試験基準よりも厳しいので、 MED要求の試験基準で試験のうえEMC指令に従ったCEマークを貼り付けるのが妥当であると考えられます。
適合宣言書 Declaration of Conformity
MEDのみならず他の指令でも同様ですが、CEマーキング全てに要求されるのが適合宣言書です。
これは製品が MED指令に従い設計、製造され、検査に合格したことを製造者またはその販売者が自ら宣言し、またトレーサビリティーを確保するために発行が義務付けられているものです。
MED認定品を探す
MEDの認定機関の集まりによりMED専用のホームページが開設されています。各認定機関が定期的にデータを更新することにより、認定品があらゆる条件を入力して検索することができます。
初めに登録をしてIDとパスワードを取得する必要がありますが、認定品のみならず、MEDに関する情報が得られるのでとても便利です。
https://portal.med.emsa.europa.eu/
USCGとの相互認証
2004年2月27日、ヨーロッパ( European Commission )とアメリカ合衆国間において、舶用品の相互認証 MRA )について合意がなされ、この7月1日から発効となりました。これは1998年からEU、アメリカ沿岸警備隊USCG 、米国通商代表部(USTR)により、大西洋を挟んだ舶用品の自由流通を求めるために協議されてきたものです。
この相互承認の 対象品 は、5つのカテゴリーのうち、MARPOL、無線機器を除く防火材料、人命救助機器、航海計器であり、現在のMED対象品の全てではありませんが、今後も相互の協議によって追加されてゆくものと思われます。
相互認証により発行される型式証書は、現在発行済のものと全体のデザインは変わりませんが、右上のところのMED item number A.1/1.XX などの下に USCG Approval Category numberが追記されます。
製品に は舵輪マークに加えUSCGitem番号を列記する必要があります。
MEDの維持・管理はどうする?
モジュールB :型式承認証書 EC Type Examination Certificate )の有効期限について、決まりはありませんがほとんどの認定機関は 5 年間の期限を定めています。この有効期限中に国際条約の改正等で更新が必要となる場合がありますが、更新時に最新のテスト基準によるテストレポートが必要となります。
モジュールD 、 Eについては 3 年間有効の "QUALITY SYSTEM APPROVAL CERTIF ICATE" が発行されますが、年1 、 2 回の品質管理状態を確認する維持審査が必要となります。 BUREAU VERITASは維持審査の数カ月前にご担当者あてに維持審査のお知らせの FAX をお送りし、受審査による認証失効を未然に防ぎます。
英語が苦手で...
ご安心ください。
BUREAU VERITASでは皆様の負担を考え、なるべく日本語で取得できるよう配慮しております。
ただし型式承認は BUREAU VERITAS本社で承認となりますので図面、テストレポートは英文で作成、提出をお願いします。
日本国内での対応
日本国内ではBUREAU VERITAS神戸内の MED担当のセクションで MEDについての一括管理を行い、取得から運用におけるあらゆる皆様の疑問、問題点にお答えできるように、また BUREAU VERITAS横浜には審査員を配置し、日本全国のお客様に対応できる体制を取っています。
